コラーゲンの分子構造
今回はコラーゲンの分子構造について少し詳しく説明します。
これまでも解説していますが、動物がここまで高度に進化できたのはコラーゲンというタンパク質が存在したからと言っても過言ではなく、皮膚や骨や軟骨、血管などの様々な臓器に欠かせないものです。
では、なぜコラーゲンがそんな大切な役割を担うことができるタンパク質なのでしょうか?
それは、ひとことで言うと「繊維構造」だということです。
繊維と言えば「食物繊維」が思い浮かびますが、食物繊維も植物の高度な進化には大切な役割を果たしていますから、高度な生命には「繊維」がポイントだということになります。
コラーゲンの分子構造
では、タンパク質の繊維であるコラーゲンの構造について、その繊維を解くように詳しく解説してみましょう。
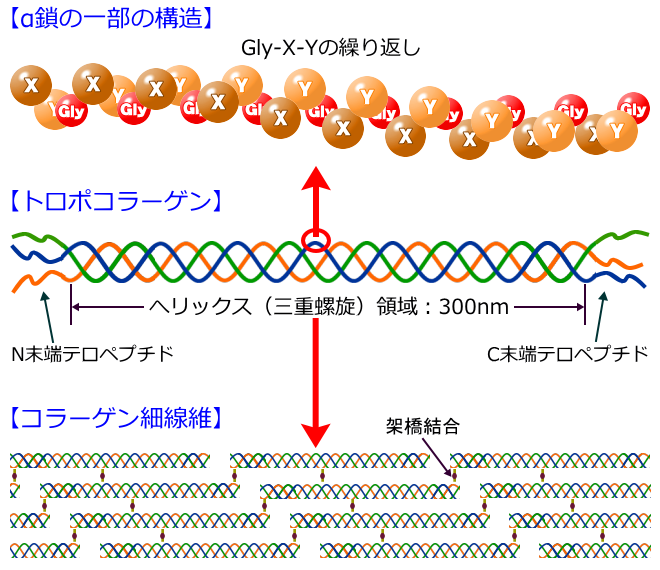
コラーゲン繊維の最小の1本は、約20種類のアミノ酸がつながった「ポリペプチド鎖(α鎖)」です。
体内のコラーゲンで一番多いⅠ型コラーゲンのα鎖は、アミノ酸残基数1,000程度のポリペプチドで分子量約10万です。
そして、このα鎖3本が左巻きの螺旋(らせん)状に絡み合い、分子量約30万で長さ約300nm(ナノメートル)、直径が約2nmの細長い棒状のタンパク質となり、これを「トロポコラーゲン」と言いコラーゲン分子のことを指します。<1nm=100万分の1㎜>
図は、細胞から分泌されたばかりでN末端とC末端が付いた状態(プロコラーゲン)ですが、その両末端が酵素によって切断されたものが「トロポコラーゲン」です。
そしてさらに、トロポコラーゲン同士が1分子の約1/4にあたる67nmごとに規則的にずれて各鎖間に架橋結合が形成されて線維束を形成しており、これを「コラーゲン細線維」と言います。
このコラーゲン細線維がさらに多く寄り集まって、結合組織内で強大な線維を形成しており、これが「コラーゲン線維」と言われます。
まとめると、
アミノ酸 ⇒ ポリペプチド(α鎖) ⇒ トロポコラーゲン ⇒ コラーゲン細線維 ⇒ コラーゲン線維
となります。
コラーゲンのアミノ酸組成
アミノ酸組成とは、タンパク質やペプチドを構成するアミノ酸の種類と量です。
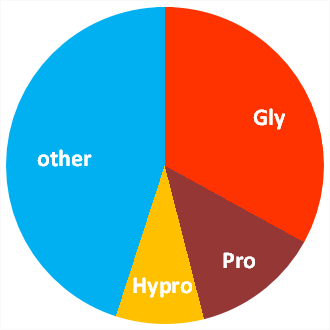
人間のコラーゲンのアミノ酸組成は、20種類のアミノ酸にによって構成されており、その20種類のアミノ酸が一定の規則で鎖状(α鎖) に繋がり、そのα鎖3本が互いに巻き付き合い強固な三重らせんとなっています。

ここに示すのは分子のごく一部で、各鎖ともアミノ酸約20個ずつを含む部分で、3つのアミノ酸を繰り返す配列が頑丈な構造を形成しています。3つごとに配置されているアミノ酸は「グリシン」と呼ばれ、コラーゲンのアミノ酸組成の約3分の1を占めており、らせんの内側にぴったり適合する小さいアミノ酸です。
残りの約3分の1が2つのアミノ酸「プロリン」と「ヒドロキシプロリン」で占められており、特に「ヒドロキシプロリン」は他のタンパク質には含まれないコラーゲン特有のアミノ酸で、体中のコラーゲンを生成する細胞にシグナルを送る要素と考えられています。
コラーゲンのアミノ酸スコア
9種類の必須アミノ酸のバランスのことをアミノ酸スコアと呼びます。それぞれのアミノ酸が必要量を満たしていればアミノ酸スコアは100となりますが、1つでも必要量を満たしていなければアミノ酸スコアも減少します。
人間の身体を構成するアミノ酸は主に20種類で、体内で合成されない必須アミノ酸と、合成される非必須アミノ酸に大きく分類されます。
必須アミノ酸は、バリン・ロイシン・イソロイシン・メチオニン・リジン・フェニルアラニン・トリプトファン・スレオニン・ヒスチジンの9種類となります。
この必須アミノ酸は、体内では合成されないので食物で補給しなければなりません。この必須アミノ酸のひとつである「トリプトファン」を全く含まないため、コラーゲンやゼラチンのアミノ酸スコアは0となります。
コラーゲンの役割
コラーゲンは、様々な役割があります。今回は、主な役割となる3つをご紹介します。1つ目は、「肌の役割」。2つ目は、「関節の役割」。3つ目は、「骨の役割」です。これらを詳しく解説していきます。
コラーゲンは、真皮の部分に含まれおりヒアルロン酸やエラスチンなどと肌を内側から支えハリと弾力を与えて健康的な肌を保つ働きをしています。肌は、表皮・真皮・皮下組織の3つに分けられます。体内のコラーゲン合成が促進されると、シワやたるみなどの老化を防ぐ役割が期待できます。
関節は、骨と骨のクッションの役割をしている重要な場所で、この役割を担う軟骨のおよそ50%はコラーゲンで構成されています。コラーゲンは、弾力性のある柔らかい軟骨を作り、関節痛になりにくい役割が期待できます。
骨は、コラーゲンの周りにカルシウムなどのミネラルが付着することで骨が作られます。構成する80%の成分は主にカルシウムやミネラルで、20%がコラーゲンなどのタンパク質とされています。つまり、コラーゲンは強い骨が作られ健康な身体を維持する役割が期待できます。
これら以外にも、筋肉量を増やす手助け、血圧や血糖値を調整する役割、抜け毛や白髪を防ぐ美しい髪の役割、動脈効果を防ぐ効果、自己治癒を促進する役割など…様々な効果が期待できます。
コラーゲンと食物繊維
コラーゲンと食物繊維を同時に摂取することでダイエット効果が促進されると言われています。
コラーゲンには新陳代謝を活発にする働きと、体内で不要となった老廃物を出してくれる手助けをしてくれる働きが期待できます。つまり、コラーゲンに含まれるアミノ酸で脂肪燃焼効果と便秘解消も手助けすることが期待されています。
食物繊維に大きく水溶性と不溶性があり、それぞれ血糖値の上昇を抑えたり、おなかの調子を整えてくれる整腸作用が期待できます。たんぱく質・脂質・炭水化物などの成分は、消化管のなかで消化されて小腸から体内に吸収されますが、食物繊維は消化されることなく小腸を通過します。その結果、少量で食事を済ませるダイエット効果も期待できます。
コラーゲンとゼラチンとコラーゲンペプチド
私たちの体内にあるコラーゲンは、三重らせん構造をした繊維状のたんぱく質です。ゼラチンは、そこに熱を加えて三重らせん状のコラーゲン分子がほぐれたもので、分子同士のつながりが切れ丸まったような形に変化し、加熱すると溶けて冷やすとゲル化するという特徴があります。コラーゲンペプチドは、ゼラチンをさらに分解し分子を細かくして美容や健康に特化したもので、冷やしてもゲル化しないため、ほとんどのサプリメントにはコラーゲンペプチドがコラーゲンとして使用されています。
毎日、私たちが食べている食事や飲み物などに入れて摂取することができます。
コラーゲンペプチドの消化吸収
コラーゲンペプチドは、普通のコラーゲンよりも吸収性が高く、美容・健康に高い効果を得られたという研究結果が報告されています。
一般的に、食品からコラーゲンを摂取した場合は、消化分解効率が良くありません。しかし、低分子の「コラーゲンペプチド」の状態で経口摂取した場合は、消化分解工程を短縮することができます。つまり、コラーゲンペプチドは体内に効率よく届くのです。
トリペプチドとジペプチドの細胞内での影響
コラーゲントリペプチドは「ヒドロキシプロリン」を含む3個のアミノ酸からできたコラーゲンペプチドです。コラーゲンジペプチドも「ヒドロキシプロリン」を含む2個のアミノ酸からできたコラーゲンの最小単位で、それぞれそのまま小腸から素早く吸収されていきます。このトリペプチドとジペプチドが皮膚や骨、軟骨、腱などのコラーゲンを生成する細胞に運搬されると、コラーゲンが分解されているというサインとして反応し、コラーゲンの生成が活性化すると考えられています。
コラーゲンの代謝と血中ペプチド濃度との関係
コラーゲンを摂取することで新陳代謝を促進する効果や血流を増やすなどの基礎代謝促進が期待できます。ですが、コラーゲンを食べ物から摂取した場合は体内に吸収される過程で分解されてしまう可能性があります。また、吸収が遅いことも懸念されます。
ですが、コラーゲンサプリを経口摂取した場合は血中と皮膚にまでトリペプチドやジペプチドが高濃度に届くという研究結果も報告されています。
ですので、コラーゲンサプリを継続時に摂取することが1番効率の良い摂取方法だと言えます。
以上、コラーゲンの分子構造について解説しました。